金属与盐的反应规律
金属与盐反应要满足两个条件:
①活泼金属置换不活泼金属(即金属活动性顺序表中排在前面的金属置换后面的金属);
②盐溶液必须可溶于水。
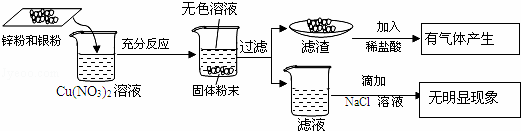
如Fe+CuSO₄=FeSO₄+Cu,Cu+2AgNO₃=Cu(NO₃)₂+2Ag,而Cu+AgCl=不反应,因为AgCl难溶于水,Fe+ZnCl₂=不反应,因为Zn比Fe活泼(金属活动性顺序表中Fe排在Zn的后面)。
若金属是K、Ca、Na很活泼的金属与盐溶液反应要先考虑与水反应,反应生成的碱再与盐反应,如Na与CuSO4溶液反应:2Na+H₂O=2NaOH+H₂↑,2NaOH+CuSO₄=Na₂SO₄ +Cu(OH)₂↓
按反应物与生成物的类型分四类:化合反应、分解反应、置换反应、复分解反应
按电子得失可分为:氧化还原反应、非氧化还原反应;氧化还原反应包括:自身氧化还原,还原剂与氧化剂反应
异构化:(A →B) :化合物是形成结构重组而不改变化学组成物。
扩展资料:
假设,存在一个系统。通过计算得出反应前后系统的焓变为ΔH。
如果ΔH 计算为负值,则反应必为放热反应。比如:燃烧就是燃料与空气中氧气剧烈反应放出热量。
如果ΔH 计算是正值,则反应必为吸热反应。比如:石灰石在高温下反应分解出氧化钙(生石灰)和二氧化碳。
如果ΔH计算等于零,则反应不吸热也不放热;外界不对体系做功,体系也不对外界做功。
反应到底是吸热还是放热完全由体系的 ΔH决定。但是,反应是否进行则完全由体系的由吉布斯自由能ΔG来表示。具体计算公式如下:
ΔG = ΔH - TΔS
ΔG 是自由能改变,ΔH 是焓改变,而ΔS 则为熵改变,T是开尔文温度。
金属分为活性金属和钝性金属两种。 根据金属活动性顺序,氢前金属称为活性金属,氢后金属就是钝性金属。
1、氢前面的金属能与弱氧化性强酸反应,置换出酸中的氢(浓硫酸、硝酸强氧化性强酸与金属反应不生成氢气)。
如:Fe + 2HCl ═ FeCl2 + H2↑
2、活动性强的金属能与活动性弱的金属盐溶液反应。
3、大多数金属能与氧气反应。
4、排在H前面的金属,理论上讲都能与水发生化学反应。在常温下,钾,钙,钠等能与水发生剧烈反应,镁、铝等能与热水反应,铁等金属在高温下能与水蒸气反应。
5、金属均无氧化性,但金属离子有氧化性,活动性越弱的金属形成的离子氧化性越强。
6、金属都有还原性,活动性越弱的金属还原性越弱。
参考资料:百度百科---化学反应