水的电离和溶液的pH
1、1.溶液的酸碱性
溶液的酸碱性取决于溶液中c(H+)和c(OH-)的相对大小。
(1)酸性溶液:c(H+)>c(OH-),常温下,pH<7。
(2)中性溶液:c(H+)=c(OH-),常温下,pH=7。
(3)碱性溶液:c(H+)<c(OH-),常温下,pH>7。
2、溶液的酸碱性与pH的关系

3、溶液pH的计算
(1)单一溶液的pH计算

4、(2)混合溶液pH的计算类型

5、1.稀释规律
酸、碱溶液稀释相同倍数时,强电解质溶液比弱电解质溶液的pH变化幅度大,但不管稀释多少倍,最终都无限接近中性。
6、酸碱混合规律
(1)等浓度等体积一元酸与一元碱混合的溶液——“谁强显谁性,同强显中性”。
(2)25 ℃时,pH之和等于14时,一元强酸和一元弱碱等体积混合呈碱性;一元弱酸和一元强碱等体积混合呈酸性。即谁弱谁过量,显谁性。
(3)强酸、强碱等体积混合(25 ℃时)
①pH之和等于14呈中性;②pH之和小于14呈酸性;③pH之和大于14呈碱性。
1、1.实验原理
利用酸碱中和反应,用已知浓度酸(或碱)来测定未知浓度的碱(或酸)的实验方法。以标准盐酸溶液滴定待测的NaOH溶液,待测的NaOH溶液的物质的量浓度为c(NaOH)=c(HCL)v(HCL)/v(NAOH)。
2、2.实验用品
(1)仪器
图(A)是酸式滴定管、图(B)是碱式滴定管、滴定管夹、铁架台、锥形瓶。
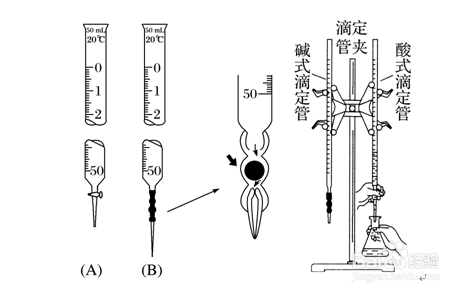
3、滴定管
①构造:“0”刻度线在上方,尖嘴部分无刻度。
②精确度:读数可估计到0.01 mL。
③洗涤:先用蒸馏水洗涤,再用待装液润洗。
④排泡:酸、碱式滴定管中的液体在滴定前均要排出尖嘴中的气泡。
使用注意事项

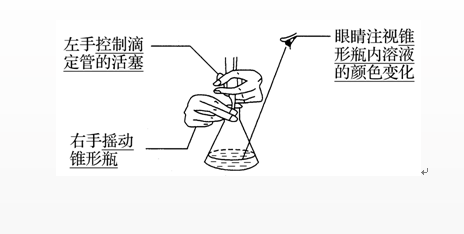
4、终点判断
等到滴入最后一滴标准液,指示剂变色,且在半分钟内不恢复原来的颜色,视为滴定终点并记录标准液的体积。
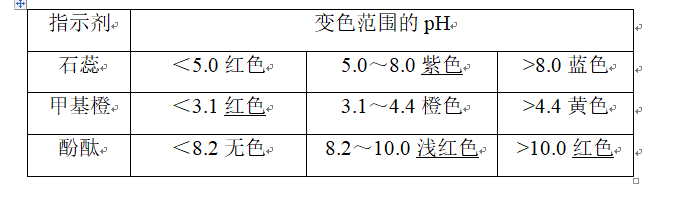
5、常用酸碱指示剂及变色范围
声明:本网站引用、摘录或转载内容仅供网站访问者交流或参考,不代表本站立场,如存在版权或非法内容,请联系站长删除,联系邮箱:site.kefu@qq.com。
阅读量:54
阅读量:150
阅读量:73
阅读量:89
阅读量:80