蛋白质的表达、分离、纯化实验
1、实验方法原理
携带有目标蛋白基因的质粒在大肠杆菌BL21中,在 37℃,IPTG诱导下,超量表达携带有6个连续组氨酸残基的重组氯霉素酰基转移酶蛋白,该蛋白可用一种通过共价偶连的次氨基三乙酸(NTA)使镍离子(Ni2+)固相化的层析介质加以提纯,实为金属熬合亲和层析(MCAC)。蛋白质的纯化程度可通过聚丙烯酰胺凝胶电泳进行分析。
2、一、试剂准备
1. LB液体培养基:Trytone 10 g, yeast extract 5 g,NaCl 10 g,用蒸馏水配至1000 mL。
2. 氨苄青霉素:100 mg/mL。
3. 上样缓冲液:100 mM NaH2PO4,10 mMTris,8M Urea,10 mM 2-ME,pH8.0。
4. Washing Buffer:100 mM NaH2PO4,10 mMTris,8 M Urea,pH6.3。
5. Elution Buffer:100 mM NaH2PO4,10 mMTris,8M Urea, 500 mM Imidazole, pH8.0。
6. IPTG:100mM IPTG(异丙基硫代-β-D-半乳糖苷):2.38g IPTG溶于100ml ddH2O中,0.22μm滤膜抽滤,-20℃保存。
3、二、获得目的基因
1. 通过PCR方法:以含目的基因的克隆质粒为模板,按基因序列设计一对引物(在上游和下游引物分别引入不同的酶切位点),PCR循环获得所需基因片段。
2. 通过RT-PCR方法:用TRIzol法从细胞或组织中提取总RNA,以mRNA为模板,逆转录形成cDNA第一链,以逆转录产物为模板进行PCR循环获得产物。

4、三、构建重组表达载体
1. 载体酶切:将表达质粒用限制性内切酶(同引物的酶切位点)进行双酶切,酶切产物行琼脂糖电泳后,用胶回收Kit或冻融法回收载体大片段。
2. PCR产物双酶切后回收,在T4DNA连接酶作用下连接入载体。
5、四、获得含重组表达质粒的表达菌种
1. 将连接产物转化大肠杆菌DH5α,根据重组载体的标志(抗Amp或蓝白斑)作筛选,挑取单斑,碱裂解法小量抽提质粒,双酶切初步鉴定。
2. 测序验证目的基因的插入方向及阅读框架均正确,进入下步操作。否则应筛选更多克隆,重复亚克隆或亚克隆至不同酶切位点。
3. 以此重组质粒DNA转化表达宿主菌的感受态细胞。
6、五、氯霉素酰基转移酶重组蛋白的诱导
1. 接种含有重组氯霉素酰基转移酶蛋白的大肠杆菌BL21菌株于5 mL LB液体培养基中(含100 ug/mL 氨苄青霉素),37℃震荡培养过夜。
2. 按1∶50或1:100的比例稀释过夜菌,一般转接1 mL过夜培养物于100 mL(含100 ug/mL 氨苄青霉素)LB液体培养基中,37℃震荡培养至OD600 = 0.6 - 0.8(最好0.6,大约需3 h)。取10 ul 样品用于SDS-PAGE 分析。
3. 对照组不加诱导剂,实验组加入IPTG至终浓度0.5 mmol/l,37℃继续培养1-3h。
4. 12 000 rpm 离心10 min,弃上清,菌体沉淀保存于-20℃或-70℃冰箱中。

7、六、氯霉素酰基转移酶重组蛋白的分离、纯化
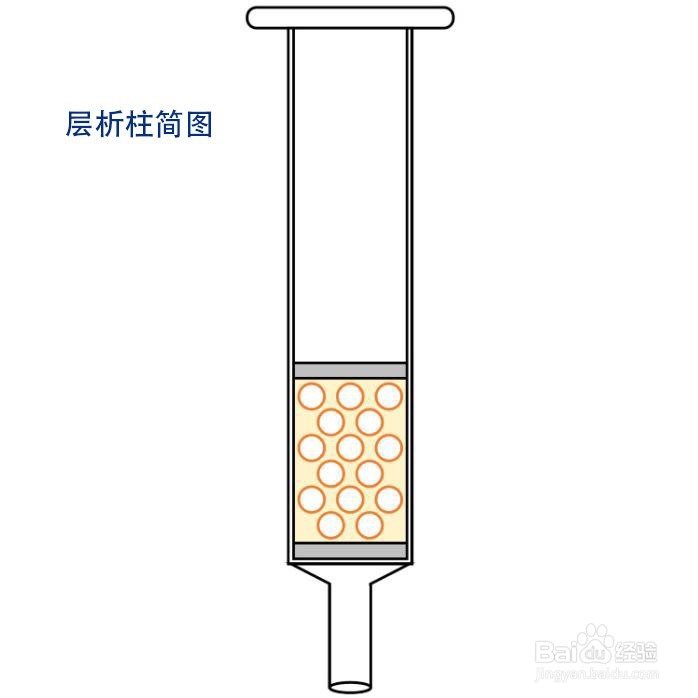
1. NTA层析柱的准备:在层析柱中加入1 mL NTA介质,并分别用8 mL 去离子水,8 mL上样缓冲液洗涤。
2. 重组蛋白的变性裂解:在冰浴中冻融菌体沉淀,加入5 mL上样缓冲液, 用吸管抽吸重悬,超声波破裂菌体,用振荡器等轻柔的混匀样品60 min,4℃ 12000 rpm 离心 30 min,将上清吸至一个干净的容器中,并弃沉淀。取10 ul 上清样品用于SDS-PAGE 分析。
3. 上清样品以10-15 mL/h 流速上Ni2+-NTA柱,收集流出液,取10 ul样品用于SDS-PAGE 分析。
4. 洗脱杂蛋白:用Washing Buffer以10-15 mL/h流速洗柱,直至OD280 = 0.01分步收集洗脱液,约3-4 h,取10 ul洗脱开始时的样品用于SDS-PAGE 分析。
5. 洗脱目标蛋白:用Elution Buffer洗柱,收集每1 mL 级分,分别取10 ul样品用于SDS-PAGE 分析。