盐水解的实质与运用
1、1.定义
在溶液中盐电离出来的离子跟水电离产生的H+或OH-结合生成弱电解质的反应。
2.实质
盐电离―→―→破坏了水的电离平衡―→水的电离程度增大
―→溶液呈碱性、酸性或中性

2、4.规律
有弱才水解,越弱越水解;谁强显谁性,同强显中性。

3、5.盐类水解离子方程式的书写要求
(1)一般来说,盐类水解的程度不大,应该用可逆号“??”表示。盐类水解一般不会产生沉淀和气体,所以不用符号“↓”和“↑”表示水解产物。
(2)多元弱酸盐的水解是分步进行的,水解离子方程式要分步表示。
(3)多元弱碱阳离子的水解简化成一步完成。
(4)水解分别显酸性和碱性的离子组由于相互促进水解程度较大,书写时要用“===”“↑”“↓”等。

1、1.影响盐类水解平衡的因素
(1)内因:形成盐的酸或碱越弱,其盐就越易水解。如水解程度:Na2CO3>Na2SO3,Na2CO3>NaHCO3。

2、以FeCl3水解为例[Fe3++3H2O??Fe(OH)3+3H+],以下外界条件对水解平衡的影响。
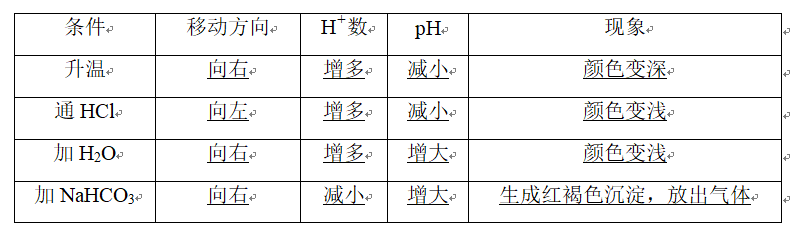
3、2.盐类水解的重要应用
(1)判断离子能否大量共存。
(2)判断盐溶液蒸干时所得的产物。
(3)保存、配制某些盐溶液。
(4)利用盐类的水解反应制取胶体、净水。

1、(1)解答此类题的思维过程
①找出存在的平衡体系(即可逆反应或可逆过程)
②找出影响平衡的条件
③判断平衡移动的方向
④分析平衡移动的结果及移动结果与所解答问题的联系

2、分析盐类水解问题的基本思路
(1)找出存在的水解平衡体系(即可逆反应或可逆过程),并写出水解反应方程式,使抽象问题具体化。
(2)然后依据水解平衡方程式找出影响水解平衡的条件,并判断水解平衡移动的方向。
(3)分析平衡移动的结果及移动结果与所解答问题的联系。
声明:本网站引用、摘录或转载内容仅供网站访问者交流或参考,不代表本站立场,如存在版权或非法内容,请联系站长删除,联系邮箱:site.kefu@qq.com。
阅读量:34
阅读量:186
阅读量:24
阅读量:39
阅读量:183