化学反应速率-高中化学尖子生提升攻略方法--1.2
1、首行我们应该明白化学反应速率反涉及到的知识点
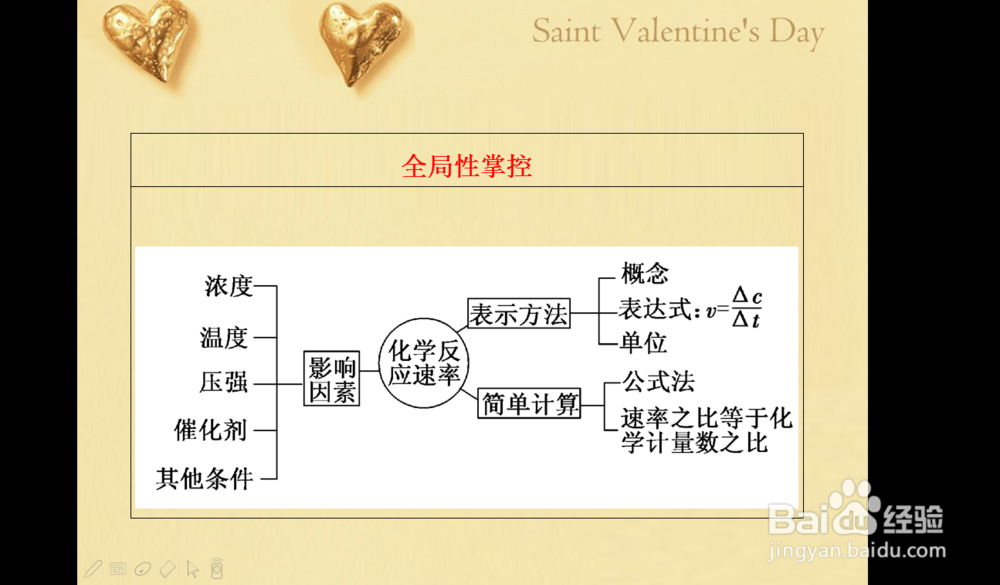
2、然后,我们应该理解高中关于化学反应速率的考点是用单位时间内的浓度变化量来表示快慢,当然也可以用物质的量,质量等等其他量的变化来表示,在这里,咱们只学精以浓度的计算来表示就可以,
注意他的单位:浓度/时间,所以常用 mol/(LxS) 当然还有其他的形式

3、化学反应的本质,我们可以用碰撞学来解释,也就是说两种或两种物质以上要相互发生化学反应,其粒子就必须发生碰撞

4、当然,,也不是任何物质之间的粒子发生碰撞就能发生化学反应,比如,常温下的煤与空气就时刻发生碰撞,但是它们没有发生化学反应,
那么我们这里就应该考虑什么情况下的碰撞才能发生化学反应呢
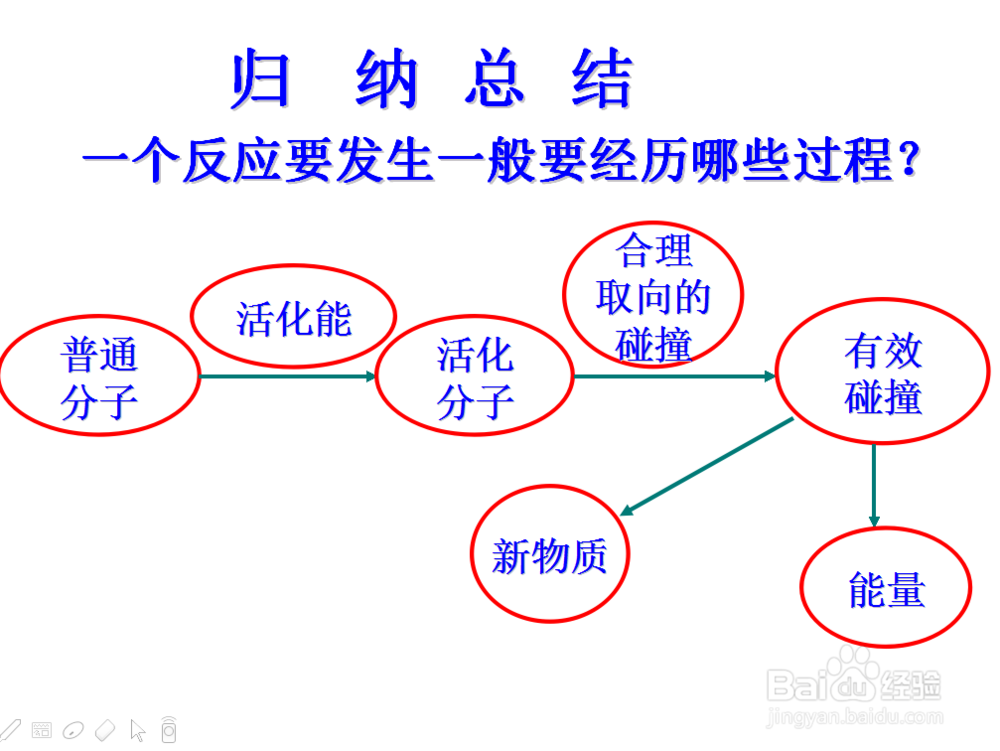
我们这里应用有效碰撞学说来解释
也就是发粒子之间发生了有效碰撞,才会发生化学反应
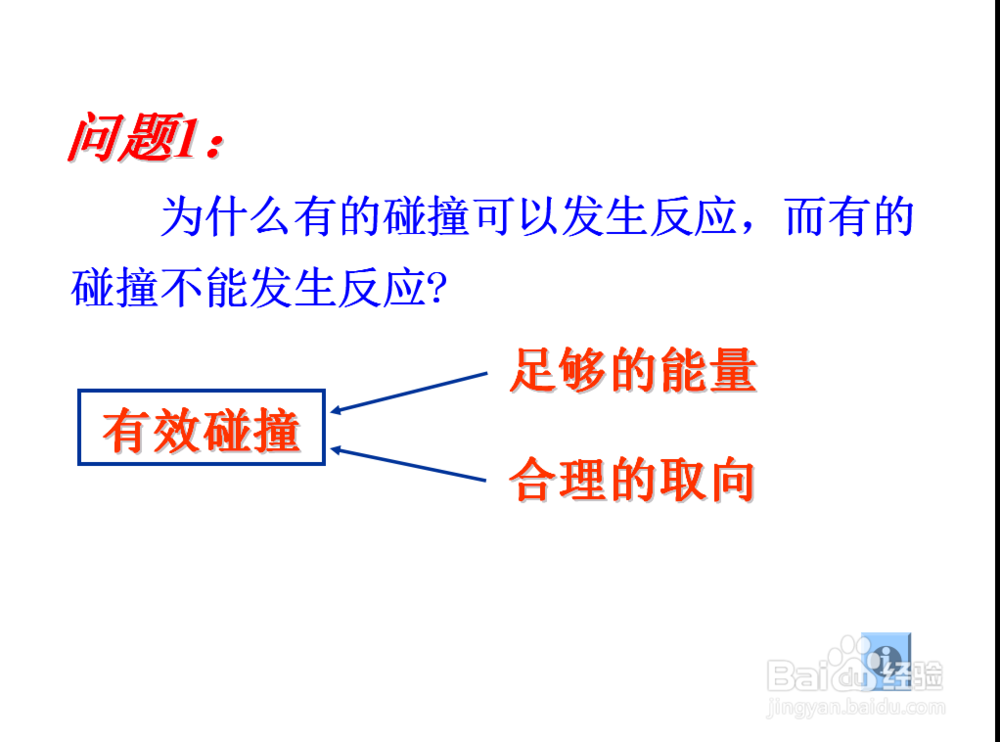
那什么是有效碰撞呢,
就是相碰的两粒子应该是肩并肩的形式,并且有足够的能量,才能发生化学反应在,两个条件缺一不可
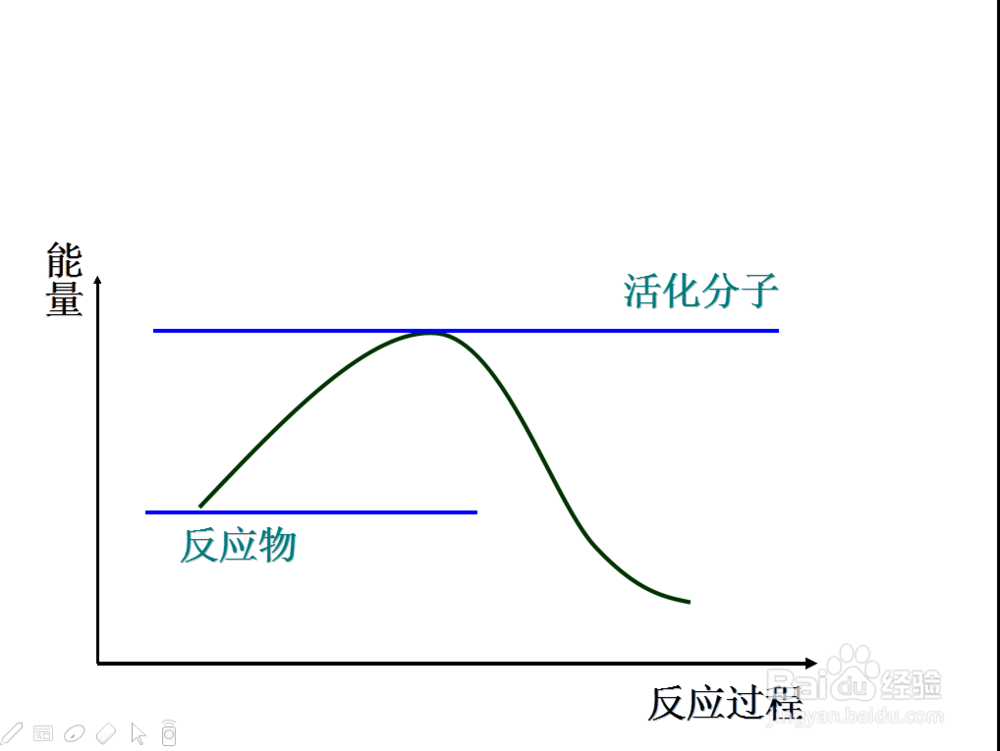
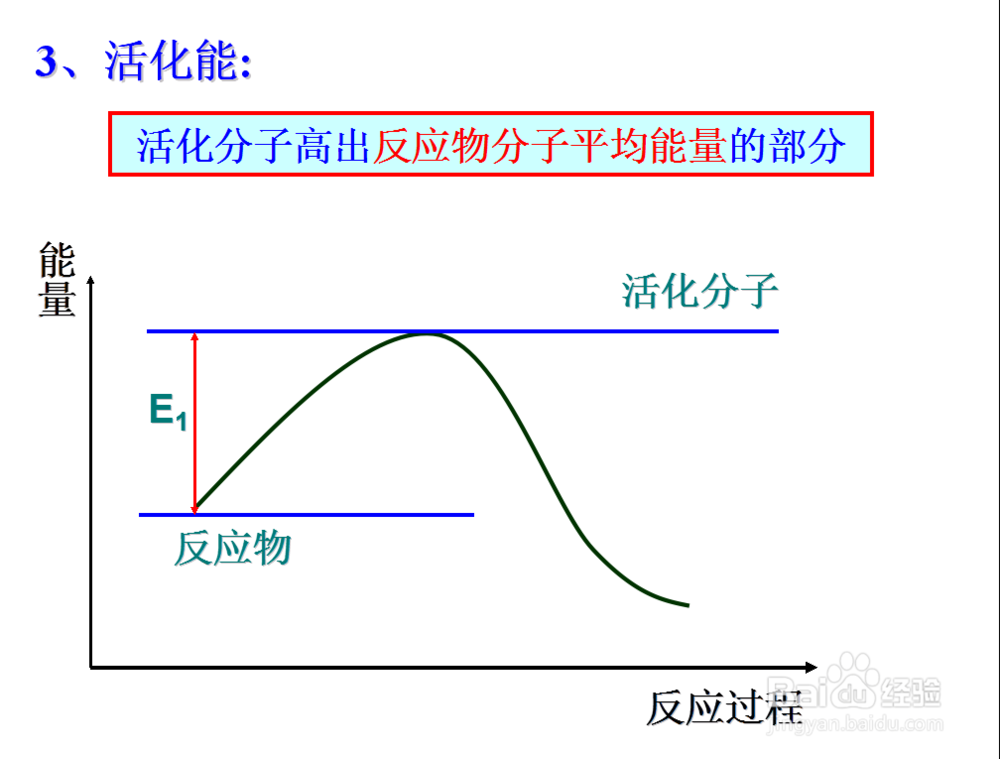
那么也引出活化分子这个概念
组成物质的粒子所具有的能量每一个都不相等,一般很少,

5、那么活化分子所具有的能量高出普通分子的那一部分就称为活化能
那么说到这里,化学反应实质上是活化分子之间的有效碰撞
也就是说活化分子之间的有效碰撞是影响化学反应速率的本质原因
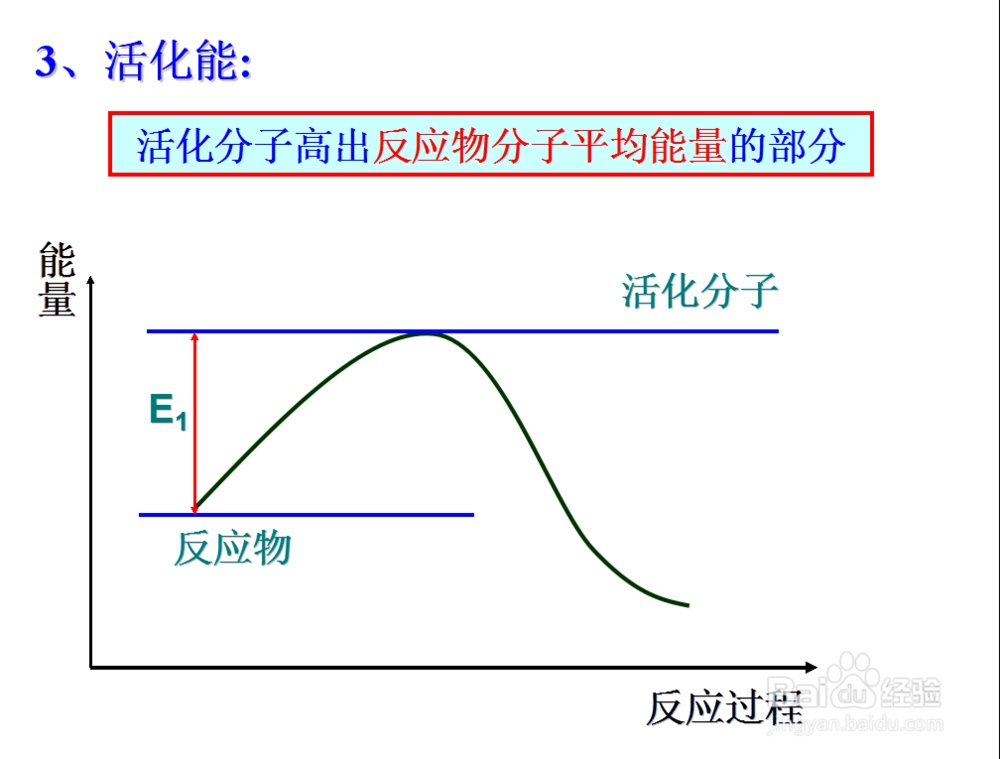
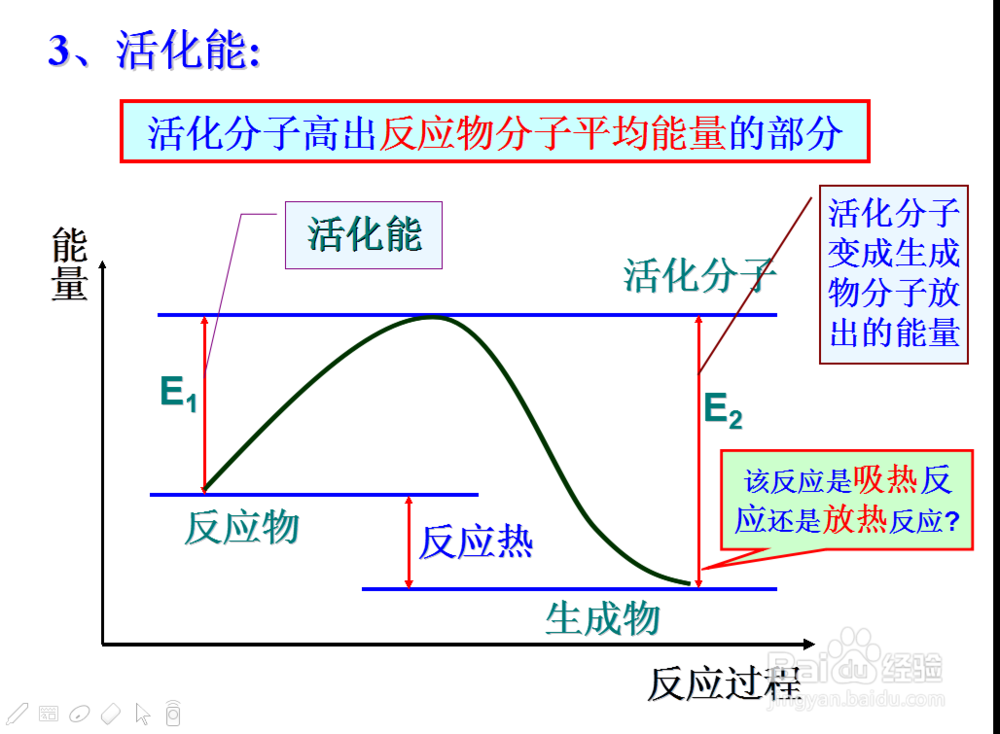

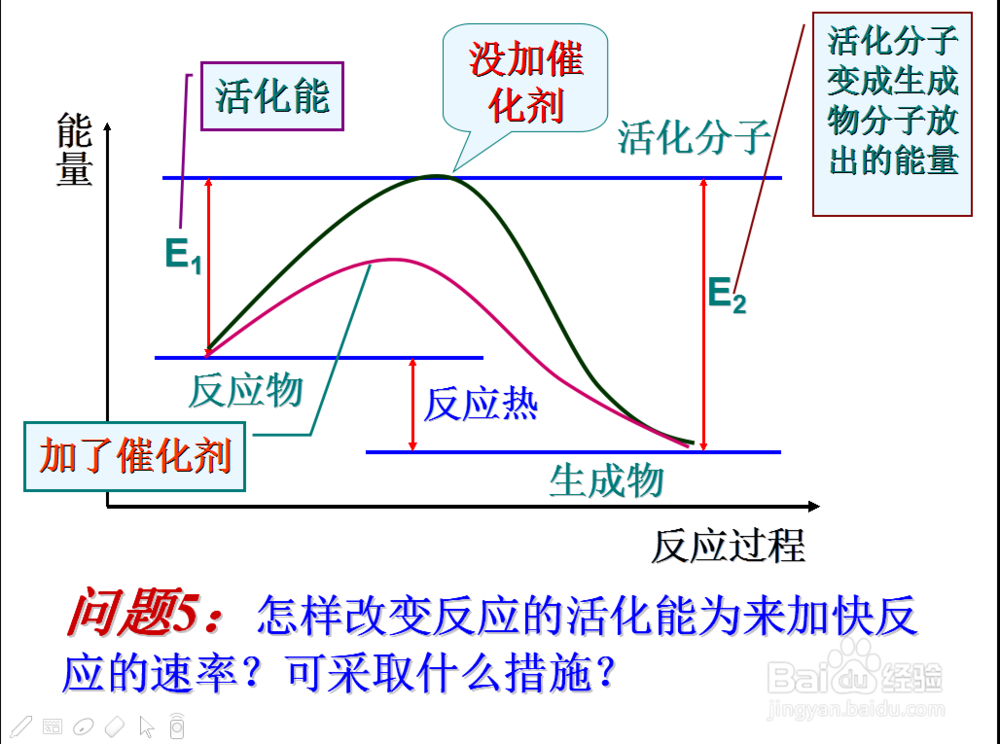
6、对于一种物质来说,其活化能越大,说明普通分子要成为活化分子所需要的能量就越多
所以活化分子的个数与活化能的大小有关
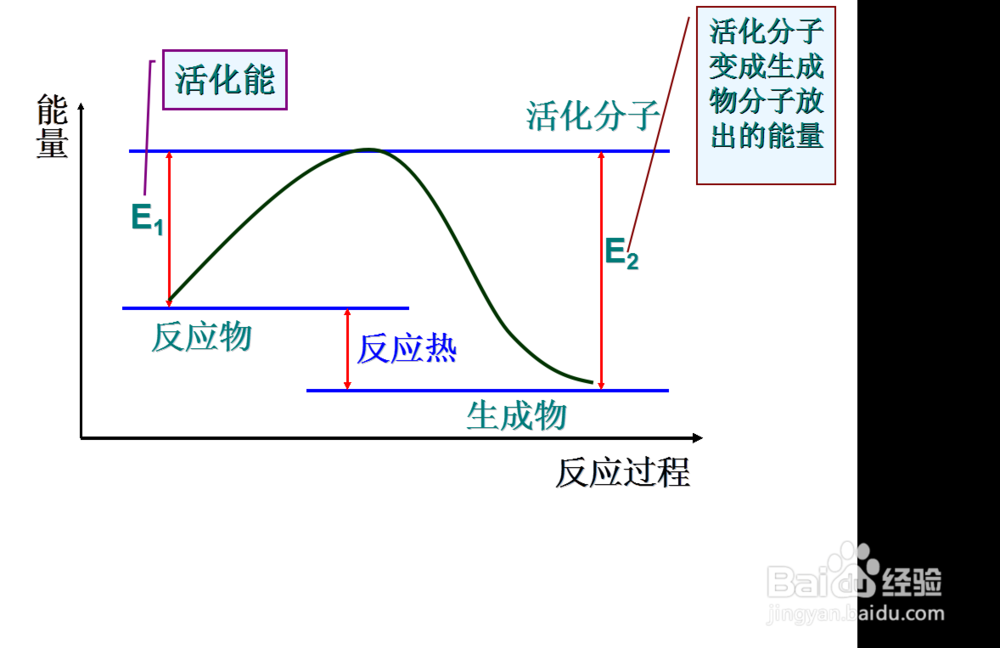
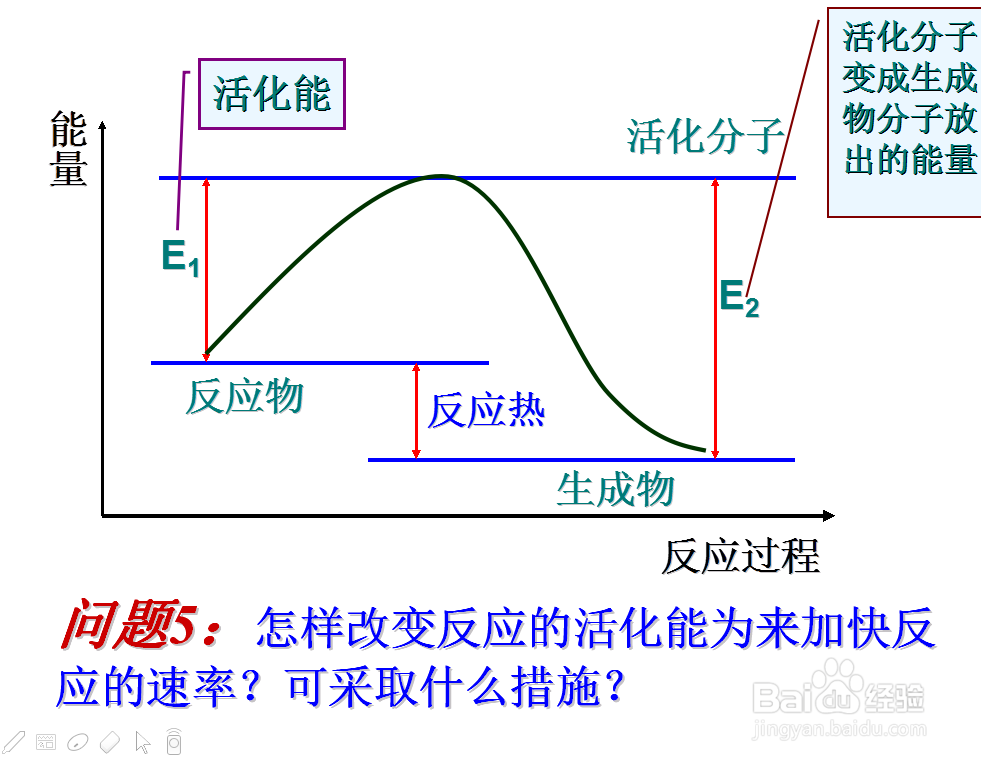
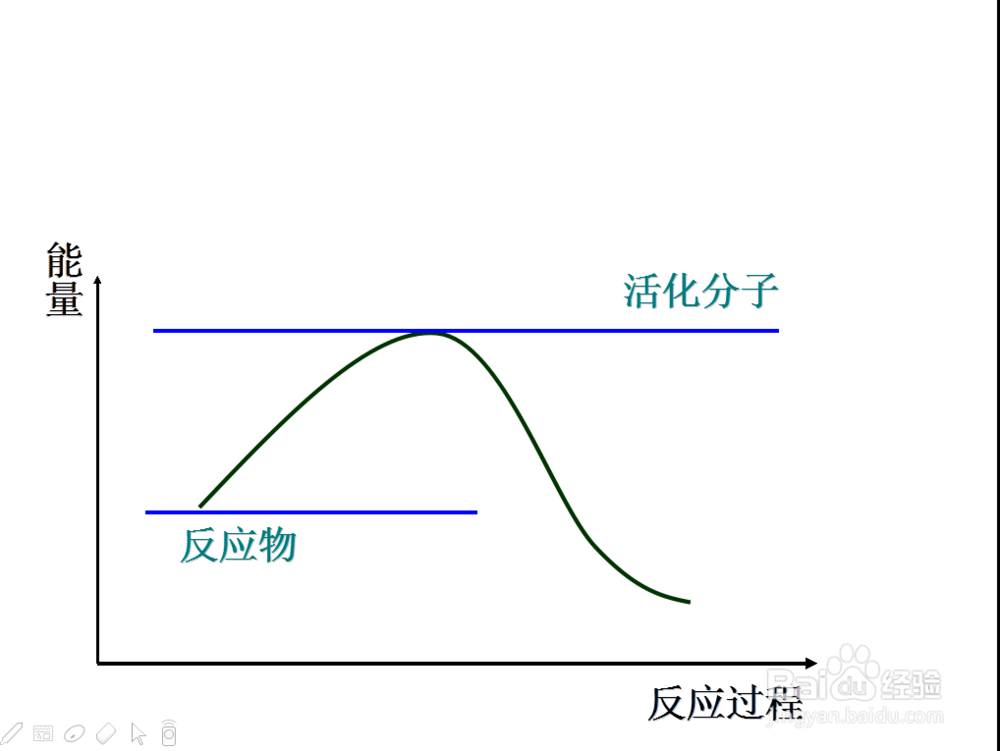

7、那么什么能够决定物质的活化能呢
当然是这种物质本身了
所以化学反应速率影响最本质的因素是物质本身
那么什么可以改变活化能大小呢


声明:本网站引用、摘录或转载内容仅供网站访问者交流或参考,不代表本站立场,如存在版权或非法内容,请联系站长删除,联系邮箱:site.kefu@qq.com。