利用“烧杯法”计算溶液的质量
1、审题:反应前、反应后的溶液分别是什么,质量是多少?

2、分析:发生了哪些化学反应?
反应前有哪些物质放入溶液中,质量是多少?
反应后有哪些物质跑出溶液,质量是多少?

3、计算H2的质量:根据化学方程式计算出6.5gZn和H2SO4反应所得H2的质量。

4、计算所得溶液的质量:反应前放入溶液的物质的质量+溶液的质量=反应后跑出溶液的物质的质量+所得溶液的质量。


1、审题:反应前、反应后的溶液分别是什么,质量是多少?

2、分析:黄铜中Zn与稀H2SO4反应,Cu不反应;因稀H2SO4足量,故Zn反应完全;剩余固体为Cu,质量3.5g,则参加反应的Zn为10—3.5=6.5(g)。
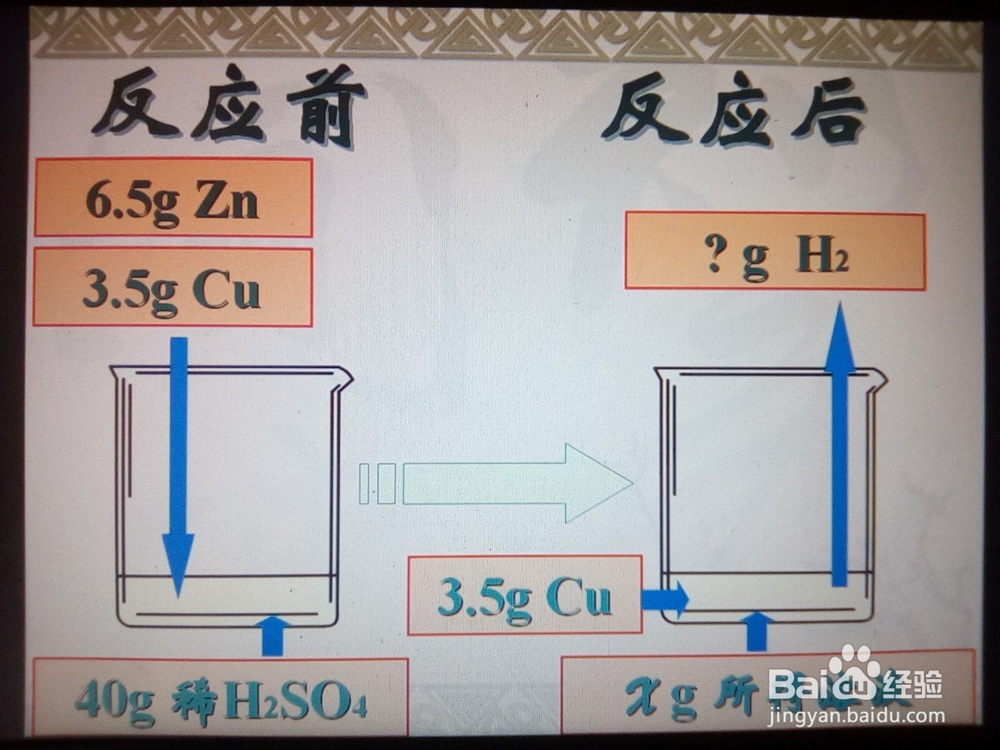
3、计算H2的质量:根据化学方程式计算出6.5gZn和H2SO4反应所得H2的质量。

4、计算所得溶液的质量:反应前放入溶液的物质的质量+溶液的质量=反应后跑出溶液的物质的质量+所得溶液的质量。
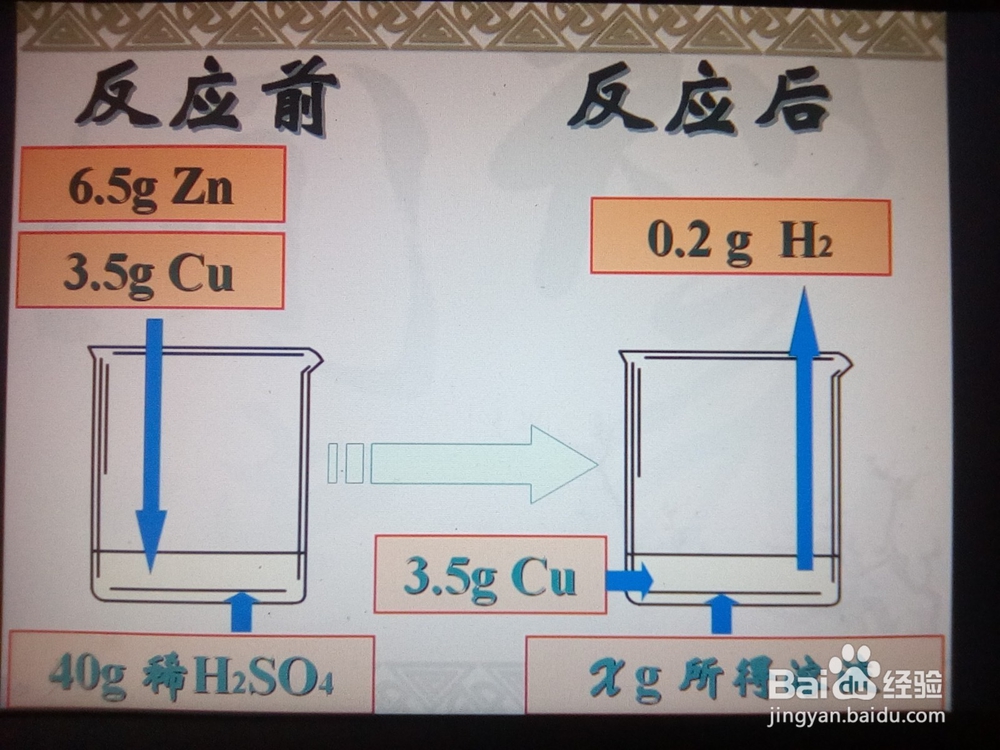

1、审题,同变式训练1,利用“烧杯法”解出所得溶液的质量。

2、根据化学方程式利用参加反应的Zn的质量计算出所得溶液中ZnSO4的质量。

3、利用公式:溶质的质量分数 = 溶质的质量 / 溶液的质量 x100% 求解。

声明:本网站引用、摘录或转载内容仅供网站访问者交流或参考,不代表本站立场,如存在版权或非法内容,请联系站长删除,联系邮箱:site.kefu@qq.com。