高中化学尖子生提升攻略方法---2.1
1、高三一轮复习
专题二
金属专题-----钠
专题二目 录
1.复习重点------------------------------ -------- 4
2. 钠的物理性质: ----------------------- ------- 4
3.钠的化学性质--------------------------- ------- 4
3.1钠与氧气的反应------------------------------- 4
3.2钠与水反应:--------------------------------- 5
3.3钠与酸反应:--------------------------------- 6
3.4钠与盐溶液反应:----------------------------- 6
4.钠的存放和取用--------------------------------- 6
5.钠的存在与用途与制取-------------------------- 6
6.钠的化合物------------------------- ------ --- -- 6
6.1.氧化钠和过氧化钠的比较----------------- -- 6
6.2.碳酸钠与碳酸氢钠-------------------------- 7
6.3.钠的其它重要化合物-------------- ---------- 7
6.4氢氧化钠---------------------- ----- --------- 7
7.焰色反应(物理方法)----------- --- ----------- 8
8.有关钠及其化合物的几个问题--------- --------- 8
8.1.金属钠露置在空气中的变化过程:---------------- 8
8.2.Na2CO3与盐酸的互滴反应------------ ---------- 8
8.3.碳酸氢钠和碳酸钠的制法----------- ------------9
9.碱金属元素:--------------------------- -------9
9.1碱金属元素的原子结构和碱金属的物理性质----------9
10.碱金属中的一般和特殊之处----- --- --- ---- --- ---10
11.附录三---- ----- - ----- ----- -- ---- - -- ---- ------11

2、主要内容
一.复习重点
1.从钠原子结构特征认识钠的化学性质;和的对比,与比较;碱金属元素的原子结构及物理性质比较
2.对实验现象的分析及钠的化学性质;与的鉴别,和之间的除杂问题
二. 钠的物理性质:金属钠是一种柔软 ,银白色、有金属光泽的金属,是热和电的良导体;它的密度为0.97g/cm3,比水的密度小,比煤油的密度大,熔点为97.81℃、沸点为882.9℃。
三.钠的化学性质
3.1钠与氧气的反应:
①金属钠放置在空气中,会迅速被氧化而生成氧化钠:4Na+O2=2Na2O,(空气中钠的切面变暗)
②在空气(或氧气)中燃烧:2Na+O2Na2O2(黄色火焰),以上反应说明Na2O2比Na2O稳定。可见,与O2反应时因条件不同而产物不同。
## 钠和氧气的反应

3、(1)实验过程:①②③④⑤⑥⑦
(2)反应原理:2Na+O2=====Na2O2,
2Na2O2+2H2O=4NaOH+O2↑
(3)注意事项
①玻璃管中装的钠不能太大,太大反应太剧烈,会将玻璃管炸裂.
②反应开始时,即钠熔成小球后要稍稍倾斜玻璃管,但是角度不能太大,以防止钠从玻璃管中脱出.并能保证空气疏通从而观察到明显现象.
③在取钠时要将其表面的氧化物用小刀除去,用纯钠进行实验.因为表面被氧化的钠在受热熔化后,钠表面会有一层黑色而影响实验现象的观察.
④加热时间不能太长,否则钠与O2迅速反应、燃烧起来,现象就不是很明显了.
⑤盛Na2O2的小试管要干燥.
(4)实验现象
钠熔成小球,先变成白色后变成淡黄色固体,淡黄色固体遇水放出使带火星木条复燃的气体.
(5)实验结论
钠熔点低,与O2加热反应生成Na2O2,Na2O2遇水生成O2.
③在氯气中燃烧:2Na+Cl2 NaCl(白烟)
④与硫单质:
3.2钠与水反应: 2Na+2H2O =2NaOH +H2 ↑
(1)实验过程
将钠用镊子从煤油中取出(解析原因),用滤纸吸干煤油,然后在玻璃片上将钠用小刀切下一小块(豆粒大小),进行观察,并注意切面的变化.
(2)注意事项
①取钠时要用镊子夹取、不能用手拿,因为易与汗液反应,灼伤腐蚀皮肤.
②取出钠后要迅速吸干煤油,并要放到玻璃上切割.
③钠用剩后要放回盛钠的试剂瓶,不能乱扔乱放,因为钠很活泼容易引起危险.
④钠与O2反应很容易,在观察钠的颜色光泽时要在切割后立即观察.
(3)实验现象
切面银白色,但迅速变暗(4Na+O2=2Na2O等)(解析原因),失去金属光泽.
(4)实验结论
金属钠硬度很小(质软),具有银白色金属光泽,很容易被空气氧化.
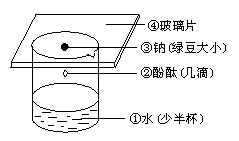
4、(5)反应原理:2Na+2H2O=2NaOH+H2↑
(6)注意事项:取钠不要太大,钠块过大,会发生爆炸.
(7)实验现象:①钠与水剧烈反应、②钠熔化成小球、③钠球在水面上不停地滚动、④有气体生成,并发出嘶嘶声.
(5)实验结论:钠与水反应剧烈,生成碱并放出气体.
3.收集并检验钠与水反应放出的气体
(1)实验过程:①②③④⑤
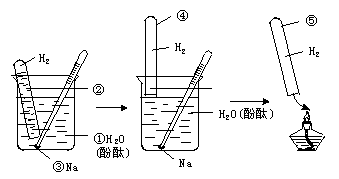
5、收集并检验Na与水反应生成的气体
图2—8
(2)反应原理:2Na+2H2O=2NaOH+H2↑,2H2+O22H2O.
(3)注意事项
①试管内要装满水,不要留有气泡,以防点燃时发生爆炸.
②钠不要太大,用刺有小孔的铝箔包住.包裹时不要用手触摸金属钠.
③试管中气体集满后,不要急于从水中取出试管,应待钠反应完毕后再取试管,以避免在取试管时,皮肤蘸上钠而灼伤.
④试管从取出到移近火焰过程中要始终倒立,点燃时可将试管微微倾斜.
(4)实验现象:试管内气体被点燃发出尖锐的爆鸣声.
(5)实验结论:钠与水反应剧烈,生成碱放出氢气.
3.3钠与酸反应:钠与酸的反应比水反应更激烈,极易爆炸。
3.4钠与盐溶液反应:先考虑钠与水反应生成NaOH,再考虑NaOH是否与盐反应。
例如:
①钠与CuSO4溶液反应
2Na+2H2O=NaOH+H2↑ (1)
CuSO4+2NaOH=Na2SO4+Cu(OH)2 (2)
合并(1)(2)得:2Na+2H2O+CuSO4=Na2SO4 +Cu(OH)2↓+H2 ↑
四.钠的存放和取用
由于金属钠的化学性质非常活泼,易与空气中的O2、H2O等反应,所以少量金属钠可保存在煤油里,大量的金属钠则存在铁筒中用石蜡密封。取用时一般先用镊子把钠从煤油中夹出来,并用滤纸把表面的煤油吸干,然后用小刀切下绿豆大小的一块再做有关实验。
五.钠的存在与用途与制取
自然界中钠只能以化合态的形态存在,主要以氯化钠的形式存在。
钠是一种强还原剂,工业上用它还原金属钛、锆、铌等;反应如:4Na+TiCl4(熔融)=Ti+4NaCl,另外钠和钾的合金在常温下呈液态,是原子反应堆的导热剂;钠也可用于制高压钠灯。




