高中化学尖子生提升攻略方法---2.2
1、采用对比方法讲解
比较内容
Na2O Na2O2
1.颜色、状态 白色固体 杰良 淡黄色固体
2.氧的化合价 —2价 —1价(过氧离子O22—)
3.电子式 (请查看相关图片)
4.稳定性较 不稳定 爹扬 较稳定
5.生成条件 通过钠的常温氧化生成 通过钠的燃烧生成
6.物质类别 碱性氧化物 过氧化物(不是碱性氧化物)
7.与水反应
Na2O + H2O==2NaOH 2Na2O2 + 2H2O==4NaOH + O2↑
8.与SO2
93与CO2反应
Na2O + CO2==Na2CO3 2Na2O2 + 2CO2==2Na2CO3 + O2
10.与盐酸反应
Na2O + 2HCl==2NaCl + H2O
2Na2O2 + 4HCl==4NaCl + 2H2O + O2↑
11.与销酸反应
12.与盐溶液反应
Na2O+ CuSO4 + H2O =Na2SO4+Cu(OH)2 ↓ (Fe3+ Mg2+ Al3+ 的盐)
2Na2O2+2CuSO4 +2H2O=2Na2SO4+2Cu(OH)2 ↓ +O2↑
13.用途
用于少量Na2O2制取 强氧化剂、漂白剂、供氧剂
14.保存 密封保存 密封保存

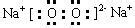
2、化学式
Na2CO3
1.俗 名 : 纯碱、苏打
易溶于水
2.色 态 : 白色粉末
3.热稳定性 : 稳定(相对碳酸氢钠来说)
4. 碱性
5.与酸的反应
H+
CO32-+2H+=CO2↑+H2O较快,分步进行
HCO3-+H+=CO2↑+H2O 剧烈
6.与NaOH 不反应
7.与石灰水的反应
CO32-+Ca2+=CaCO3↓
8.与 BaCl2 的反应
CO32-+Ba2+=BaCO3↓
9与CO2的反应
NaCO3+CO2+H2O=2NaHCO3
10.用途
用于玻璃、肥皂、造纸、纺织等工业,洗涤

3、化学式
NaHCO3
1.俗 名 : 小苏打
2. 溶解性 : 易溶于水(溶解度较Na2CO3小)
3.色 态 : 细小白色晶体
4.热稳定性 :易失水、风化
受热易分解2NaHCO3Na2CO3+H2O+CO2↑
5. 碱性
6.与酸的反应
H+
HCO3-+H+=CO2↑+H2O 剧烈
7.与NaOH的反应
HCO3-+OH—=CO32-+H2O
8.与石灰水的反应
石灰水足量: HCO3-+Ca2++OH-=CaCO3↓+H2O 石灰水不足: 2HCO3-+Ca2++2OH—=CaCO3↓+2H2O+CO32-
9.与BaCl2
不反应(若再加NaOH,则有沉淀)
10.与CO2
不反应
11.用途
发酵剂、灭火器,医疗上用于治胃酸过多
12. 两者之间的转化
(请查看相关图片)
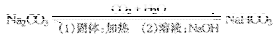


4、6.3.钠的其它重要化合物 硫酸钠
Na2SO4·10H2O,俗名:芒硝,为无色晶体。
硫酸钠用途:制玻璃、造纸、染色、纺织仗册光、制水玻璃,在医药上用作缓泻剂等。
硫酸钠分布:盐湖、海水及矿物中。
6.4氢氧化钠,氢氧化钠为白色固体,极易溶于水(并放出大量热),易吸水而发生潮解,在空气中还易变质,反应为:2NaOH+CO2=Na2CO3+H2O。
俗名:苛性钠、烧碱、火碱,氢氧化钠有很强腐蚀性,它是一种重要的碱,具有碱的通性。工业制法:2NaCl+2H2O2NaOH+H2↑+Cl2↑,
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH 保存:密封保存。试剂瓶不能用玻璃塞,应用橡皮塞。因为烧碱能与玻璃成分中的SiO2发生反应:SiO2+2NaOH=Na2SiO3+H2O,生成的Na2SiO3使玻璃塞与瓶口粘结。


